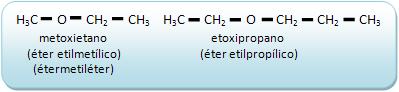
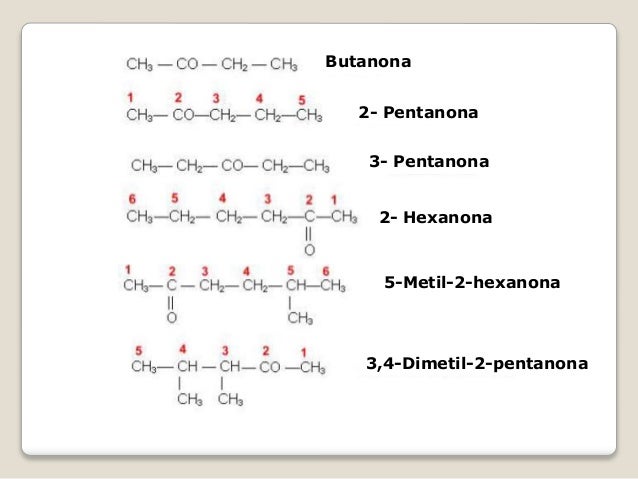
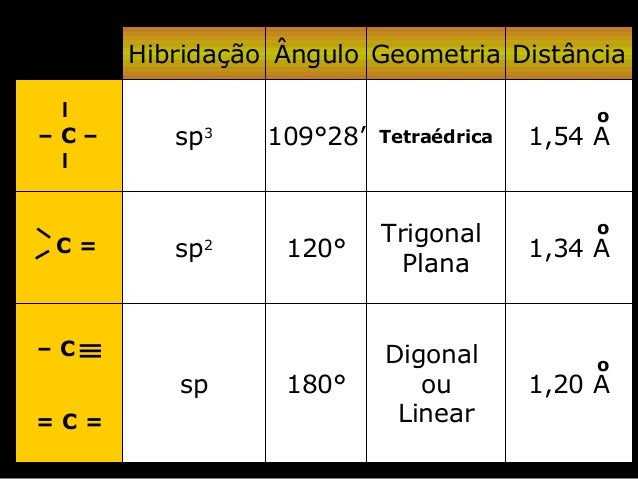
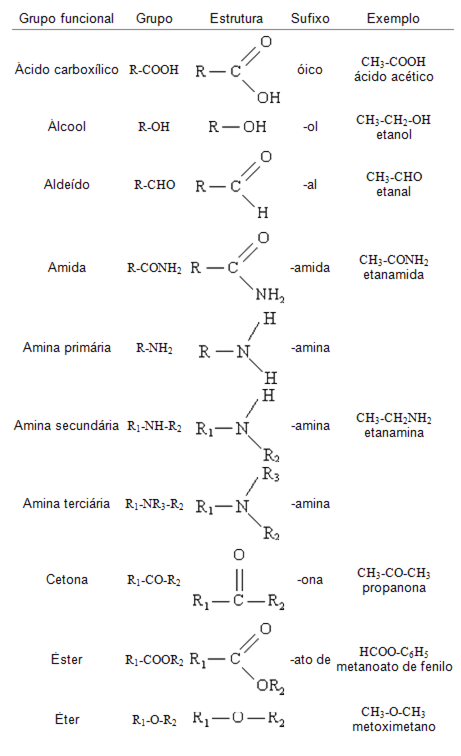
-Estruturada em 18 famílias e 7 períodos
 Período 1: K
Período 1: KPeríodo 2: K,L
Período 3: K,L,M
Período 4: K,L,M,N
Período 5: K,L,M,N,O
Período 6: K,L,M,N,O,P
Período 7: K,L,M,N,O,P,Q
Família I A: metais alcalinos
Família II A: metais alcalino-terrosos
Família III A: família do Boro
Família IV A: família do Carbono Elementos representativos: s,p
Família V A: família do Nitrogênio Elementos de transição externa: d
Família VI A: Calcogênios Elementos de transição interna: f
Família VII A: Halogênios
Família 0: Gases Nobres
Propriedades dos elementos:
-Metal: São bons condutores de calor e eletricidade.
-Ametal: não são bons condutores de calor e eletricidade, a maioria funciona como isolante.
-Gases Nobres
-Hidrogênio
Atomística
-Número atômico(Z)
Quando o átomo estar no estado fundamental(neutro), Z=p (prótons)
-Número de massa(A)
A=Z+n (nêutrons)
a) Isótopos:São átomos que apresentam o mesmo número atômico, ou seja, mesmo número de prótons, e diferentes números de massa.
b) Isóbaros:São átomos que apresentam o mesmo número de massa e diferentes números atômicos.
c) Isótopos:São átomos que apresentam diferentes números de massa e números atômicos, mas o mesmo número de nêutrons.
d) Isoeletrônicos:São átomos que apresentam o mesmo número de elétrons.
b) Isóbaros:São átomos que apresentam o mesmo número de massa e diferentes números atômicos.
c) Isótopos:São átomos que apresentam diferentes números de massa e números atômicos, mas o mesmo número de nêutrons.
d) Isoeletrônicos:São átomos que apresentam o mesmo número de elétrons.




 ,
,